Dead Cell Removal Kit
Dead cell removal이 필요한 이유
single-cell sequencing은 단일 세포 단위로 유전체, 전사체, 또는 단백체를 분석할 수 있다. 이 방법을 사용하면 조직이나 세포집합 내에서의 세포간 차이를 정밀하게 파악할 수 있다. 하지만, 이 방법의 정확성과 효율성을 유지하기 위해서는 good quality의 cell/sample을 얻는 것이 중요하다. sample quality를 높이기 위한 방법 중의 하나가 샘플내의 dead cell을 제거하는 것.
Dead cell은 여러방식으로 나타날 수 있는데, 일반적인 세포사멸은 3가지 정도로 구분되며 (apoptosis, necrosis, autophagy) 셋의 차이는 아래 참고. 이 모든 방식의 세포사멸 뿐만 아니라 pyroptosis (lytic cell death), 즉 물리적 충격등에 의해 계획없이 세포막 손상으로 세포내 물질들이 밖으로 누출되는 경우 모두 제거 대상이다.
왜냐하면,..
-
- 데이터 왜곡 감소
- dead cell내의 유전체/전사체는 생명활동을 하고 있는 Cell과는 완전 다르다. 세포내의 RNA와 DNA는 변형되거나 분해되고 있기때문에 결국엔 분석하는 데이터에 영향을 미치고 해석또한 어렵게 하기 때문이다.
-
- 효율적인 시퀀싱
- dead cell을 미리 제거하지 않더라도 분석과정에서 제거한다. 필요없는 cell을 위해서 사용된 library와 시약들을 생각하면, 미리 dead cell을 제거했을때 더 적은 resource로 더 깊게 읽을 수 있다.
-
- 염증 및 스트레스 유발 예방
- dead cell/dying cell은 inflammation과 stress response를 유발하는 경우가 많다. 이런 반응은 전사체 데이터에 분명히 영향을 미치고 주변의 다른 세포들의 상태에도 영향을 미칠 수 있기 때문에 빠르게 제거하는 것이 필요하다.
Dead Cell Removal Kit
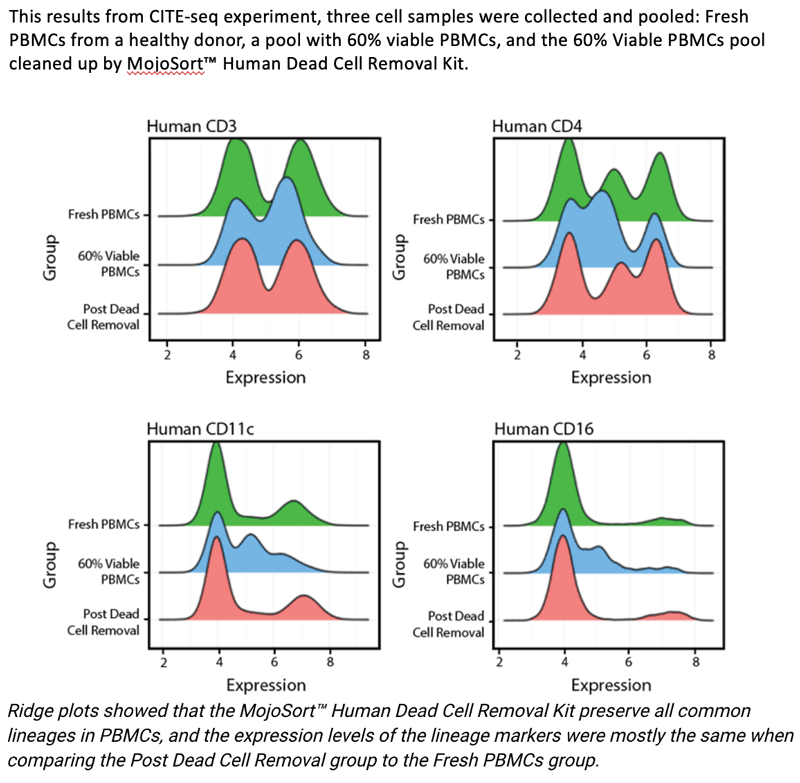
위 같은 이유로 library 생성 이전에 dead cell을 제거하는 것이 중요하다. 시판되고 있는 Dead cell Removal kit의 메커니즘과 장단점을 정리해봤다.
Miltenyi Biotec’s Dead Cell Removal Kit:
Mechanism of Action:
works through a combination of specially designed amino-reactive dye and microbeads.
어떤 dye를 사용했는지, 이 dye가 어떤 molecule과 결합하는지 알려지진 않았지만 다른 kit과 비슷하게 Annexin V를 사용할 것으로 예상된다.
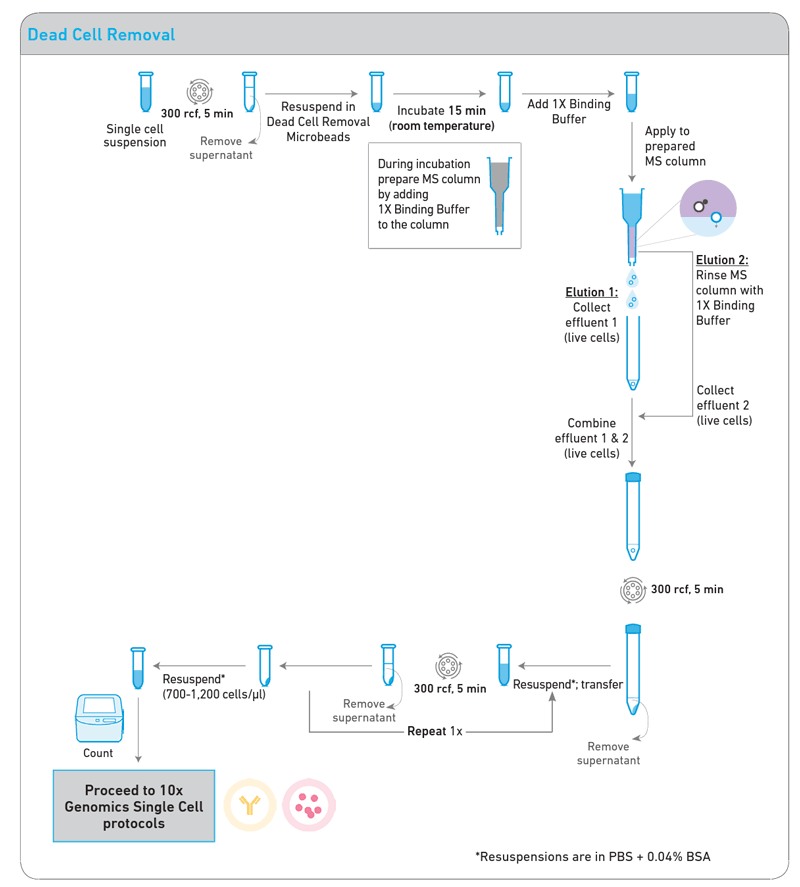
- Cell Labeling: The amino-reactive dye included in the Dead Cell Removal Kit specifically binds to dead cells. This dye penetrates the compromised membrane of dead cells and binds to intracellular amines.
- Microbead Binding: The dye-marked dead cells then bind to microbeads. These microbeads attach to a solid surface, enabling the dead cells to be captured for separation.
- Cell Separation: Finally, Magnetic-Activated Cell Sorting (MACS) technology is used to separate dead cells from live cells. The microbead-labeled dead cells are captured by a magnetic field, while the live cells pass through in a separate state.
Results:
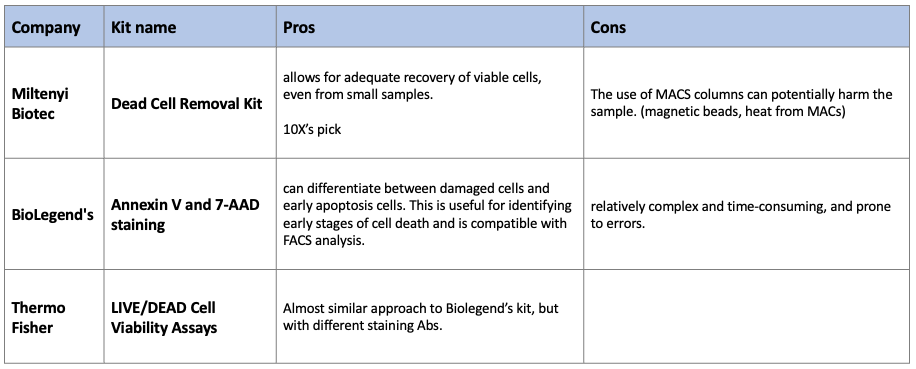
Pros
- 10X에서 선택한 dead cell removal kit (이유는 알 수 없음)
- 이미 kit로 만들어진 세트로 팔기 때문에, easy to use
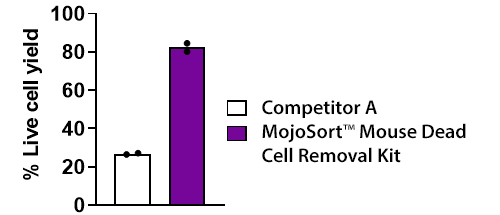
- effectively removes dead cells
- It also allows for adequate recovery of viable cells, even from small samples.
Cons
- MACs 장비 필요.
- The use of MACS columns can potentially harm the sample.
- Magnetic bead/MACs 과정에서 나오는 자기장/열에 의한 불필요한 세포 손상
BioLegend’s Annexin V and 7-AAD staining:
Mechanism of Action:
Annexin V와 7-AAD dye를 사용해서 염색을 통해 dying cell과 dead cell을 구분하고 분리해내는 방식.
- Live cells (Annexin V negative, 7-AAD negative)
- Early apoptotic cells (Annexin V positive, 7-AAD negative)
- Late apoptotic or dead cells (Annexin V positive, 7-AAD positive)
- Annexin V
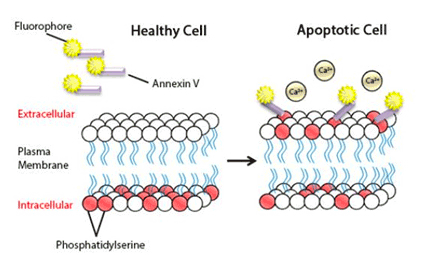
- Annexin V is a protein that binds to phosphatidylserine, a component of the cell membrane that flips from the inside to the outside early in apoptosis. In normal, healthy cells, phosphatidylserine is found only on the cytoplasmic face of the cell membrane. However, during apoptosis, phosphatidylserine translocates to the external face of the plasma membrane. Annexin V, labeled with a fluorescent dye, can then bind to these externalized phosphatidylserine residues, marking the cell as apoptotic.
- 7-AAD
- 7-Aminoactinomycin D (7-AAD) is a fluorescent dye that binds to DNA but is only permeable to cells when the cell membrane has been compromised or disrupted, as occurs in late-stage apoptosis or necrosis. Therefore, 7-AAD is used to differentiate dead cells (7-AAD positive) from live and early apoptotic cells (7-AAD negative).
After staining
- BioLegend에서는 flow cytometry를 이용해 분리해 내는 방식
- 다른 회사에서 제공하는 비슷한 dead cell removal kit도 있는데..
- BACS™의 키트는 microbubbles을 이용해서 dead cell을 분리해낸다.
Results:
Pros
- damaged cell과 early apoptosis cell 구분 가능
- MACs의 열에 의한 cell 손상 걱정 없음
Cons
- 다른 kit에 비해 time-consuming
- 오류가 생기기 쉽다고함.
- 특정 cell type에서는 recovery rate이 낮을 수 있음
- like neuronal cell type, size가 큰 cell type일수록..
LIVE/DEAD Cell Viability Assays
Annexin V and 7-AAD staining과 비슷한 원리지만 다른 dye를 사용
Mechanism of Action:
- Live Cell Staining: The assays typically use a dye like calcein AM for live cells. Calcein AM is a cell-permeant dye that can enter all cells. Once inside live cells, the non-fluorescent calcein AM is converted to a green-fluorescent calcein after acetoxymethyl ester hydrolysis by intracellular esterases, which only occur in live cells.
- Dead Cell Staining: Another dye, typically EthD-1 or propidium iodide (PI), is used to stain dead cells. EthD-1 and PI can only pass through the compromised cell membranes of dead cells. Once inside, they bind to nucleic acids, which significantly enhances fluorescence. EthD-1 emits red fluorescence, while PI emits a bright red-orange fluorescence.
정리
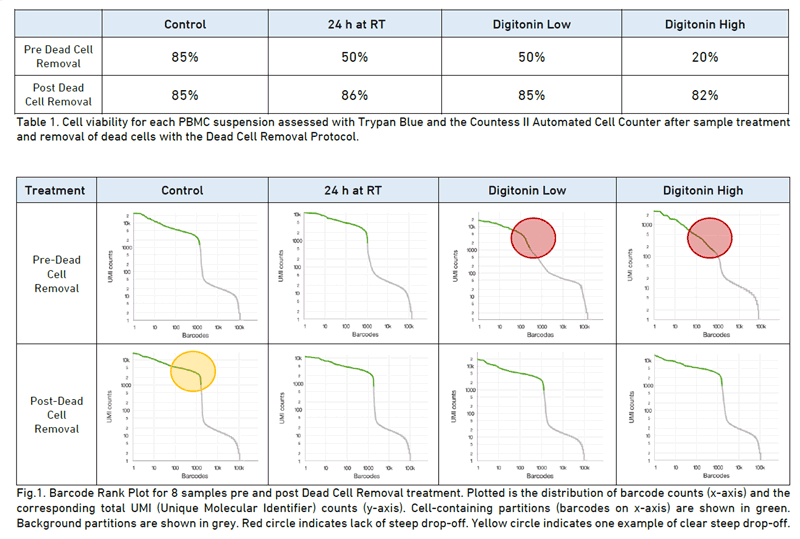
보통 이런 키트를 쓸정도의 샘플은 viavility가 좋아도 50~60%이하 일텐데 보통 키트를 사용하면 85%정도까지 끌어올릴 수 있는듯. 안쓰는 것보단 쓰는것이 쓸만한 cell에 집중하고 좋은 방법이라고 생각함.
어떤 키트를 사용할 것이냐는 샘플의 타입에 따라 결정해야할 문제. 논문을 여럿 찾아봤지만 키트간의 효율성을 비교한 논문은 없었음. 또한 이 키트를 거치면서 cell type proportion에 bias가 생기진 않을까 걱정이 있었는데 이것에 대한 trial도 없음.. 흐음
Reference
- https://cdn.10xgenomics.com/image/upload/v1660831100/support-documents/CG000093_Demonstrated_Protocol_DeadCellRemoval_RevC.pdf
- https://get.genotoul.fr/wp-content/uploads/2020/03/7-MIltenyi-4-Single-Cellsv3.pdf